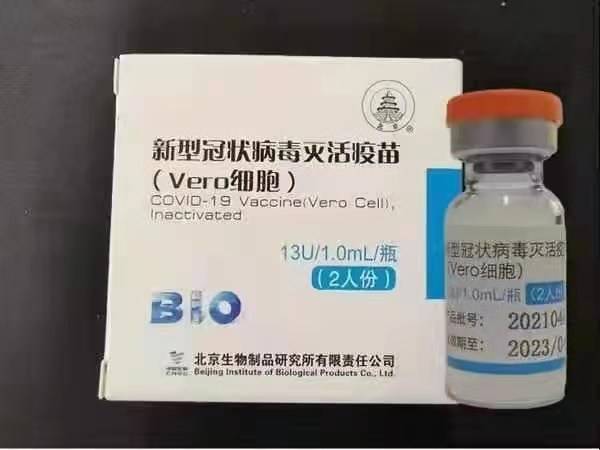
Sinopharm (Pekín): BBIBP-CorV
FASE 1
1 prueba
ChiCTR2000032459
porcelana
FASE 2
2 ensayos
NCT04962906
Argentina
ChiCTR2000032459
porcelana
FASE 3
6 ensayos
NCT04984408
ChiCTR2000034780
Emiratos Árabes Unidos
NCT04612972
Perú
NCT04510207
Bahrein, Egipto, Jordania, Emiratos Árabes Unidos
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
Emiratos Árabes Unidos
Aprobaciones
Listado de uso de emergencia de la OMS 59 países
Angola 、 Argentina 、 Bahrein 、 Bangladesh 、 Bielorrusia 、 Belice 、 Bolivia (Estado Plurinacional de) 、 Brasil 、 Brunei Darussalam 、 Camboya 、 Camerún 、 Chad 、 China 、 Comoras 、 Egipto 、 Guinea Ecuatorial 、 Gabón 、 Gambia 、 Georgia 、 Guyana 、 Hungría 、 ndonesia 、 Irán (República Islámica del) 、 Irak 、 Jordania 、 Kirguistán 、 República Democrática Popular Lao
Líbano 、 Malasia 、 Maldivas 、 Mauritania 、 auricio 、 Mongolia 、 Montenegro 、 Marruecos 、 Mozambique 、 Namibia 、 Nepal 、 Níger 、 Macedonia del Norte 、 Pakistán 、 Paraguay 、 Perú 、 Filipinas 、 República del Congo 、 enegal 、 Serbia 、 Seychelles 、 Sierra Leona 、 Salomón Islas 、 Somalia 、 Sri Lanka 、 Tailandia 、 Trinidad y Tobago 、 Túnez 、 Emiratos Árabes Unidos 、 Venezuela (República Bolivariana de) 、 Vietnam 、 Zimbabwe
Sinopharm BBIBP-CorV COVID-19 es una vacuna inactivada elaborada a partir de partículas de virus cultivadas en cultivo que carecen de capacidad patógena. Esta vacuna candidata fue desarrollada por Sinopharm Holdings y el Instituto de Productos Biológicos de Beijing.
La vacuna Sinopharm BBIBP-CorV funciona al permitir que el sistema inmunológico produzca anticuerpos contra el coronavirus beta del SARS-CoV-2. Las vacunas con virus inactivados se han utilizado durante décadas, como la vacuna contra la rabia y la vacuna contra la hepatitis A. Esta tecnología de desarrollo se ha aplicado con éxito a muchas vacunas conocidas, como la vacuna contra la rabia.
La cepa SARS-CoV-2 de Sinopharm (cepa WIV04 y número de biblioteca MN996528) se aisló de un paciente en el Hospital Jinyintan en Wuhan, China. El virus se propagó en cultivo en una línea celular Vero competente y el sobrenadante de las células infectadas se inactivó con β-propiolactona (1: 4000 vol / vol, 2 a 8 ° C) durante 48 horas. Después de la clarificación de los restos celulares y la ultrafiltración, se realizó una segunda inactivación de β-propiolactona en las mismas condiciones que la primera inactivación. Según la OMS, la vacuna se adsorbió en 0,5 mg de alumbre y se cargó en jeringas precargadas en 0,5 ml de solución salina tamponada con fosfato estéril sin conservantes.
El 31 de diciembre de 2020, la Administración Estatal de Medicamentos anunció la aprobación de la vacuna experimental desarrollada por Sinopharm.
El 7 de mayo de 2021, la Organización Mundial de la Salud anunció la aprobación de la vacuna. La lista de uso de emergencia de la OMS permitió a los países acelerar sus propias aprobaciones regulatorias para importar y administrar la vacuna COVID-19. El Grupo Asesor de Expertos de la OMS sobre Estrategias de Inmunización también ha completado su revisión de la vacuna. Con base en toda la evidencia disponible, la OMS recomienda dos dosis de vacuna, con un intervalo de tres a cuatro semanas, para adultos de 18 años o más. La eficacia de la vacuna contra la enfermedad sintomática y hospitalizada se estima en un 79% para todos los grupos de edad combinados.
La Asociación Médica Estadounidense publicó "Un ensayo clínico aleatorizado: efecto de 2 vacunas inactivadas contra el SARS-CoV-2 sobre la infección sintomática por COVID-19 en adultos" el 26 de mayo de 2021, y concluyó que "en este análisis intermedio preespecificado de un ensayo clínico aleatorizado, adultos Las 2 vacunas inactivadas contra el SARS-CoV-2 administradas en este análisis intermedio preespecificado de ensayos clínicos aleatorizados redujeron significativamente el riesgo de COVID-19 sintomático, y los eventos adversos graves fueron poco frecuentes ". En este ensayo aleatorizado de fase 3 en adultos, la eficacia de las 2 vacunas de virus completo inactivado en los casos sintomáticos de COVID-19 fue del 72,8% y el 78,1%, respectivamente. 2 vacunas tuvieron efectos adversos graves poco frecuentes con una frecuencia similar a la del grupo de control de solo alumbre, y la mayoría no estaban relacionadas con la vacunación. Un análisis exploratorio encontró que las 2 vacunas indujeron anticuerpos neutralizantes medibles, similar a los resultados del ensayo de fase 1/2.
El Grupo de Trabajo de la OMS SAGE publicó una revisión de la vacuna Sinopharm / BBIBP COVID-19 el 10 de mayo de 2021. La vacuna COVID-19 de GAVI incorpora un monitor de vial de vacuna que informa a los trabajadores de la salud si la vacuna se ha almacenado correctamente y no ha estado expuesta a calentamiento excesivo. Como resultado, el daño, según informó GAVI el 14 de mayo de 2021. Las etiquetas inteligentes fabricadas por Zebra Technologies y fabricadas por Temptime Corporation, consisten en un círculo con un cuadrado de color más claro en el medio, hecho de una sustancia química incolora que desarrolla el color de manera irreversible con el tiempo. . Esto se vuelve más oscuro para dar una indicación visual de la exposición acumulada al calor. Una vez que el vial ha sido expuesto a un calor más allá de su rango de almacenamiento óptimo, el cuadrado se vuelve más oscuro que el círculo, lo que indica que la vacuna ya no debe usarse.
Número de registro de la biblioteca de medicamentos de la vacuna National Drug BBIBP-CorV COVID-19: DB15807.